蛋白质表达与纯化实验
一、血清质形容与纯化实验性基本原理(一)通过直肠杆菌描述使用原核描述人类DNA建筑项意义结果意义是在1个适合自己的模式中,使外源人类DNA效率高表述,然后出产有附加值的蛋白质含量质车辆。1.原核菌物基因遗传表达方式的基本特征(1)原核怪物(如直肠杆菌)只能是种RNA聚合反应酶,判断原核的重启子,能崔化拥有RNA人工。(2)原核微生物的什么是基因组组展示是以使用子为机关单位名称。使用子是若干个涉及到的的结构类型什么是基因组组非常国家宏观调控区的运用,就是一个什么是基因组组展示的推进机关单位名称。(3)在原核菌物无核膜,因为转录与翻译英语工作资料是耦联的,俩者也是多次做好的。原核菌物刺绣体DNA是外露的环型DNA,转录成mRNA后,可直接的在胞浆中与核糖体运用翻译英语工作资料成血清质。每家核糖体可独有达成一道链的结合,多核糖体可同时在一道mRNA结合好几条肽链,极大提高了了翻译英语工作资料吸收率。
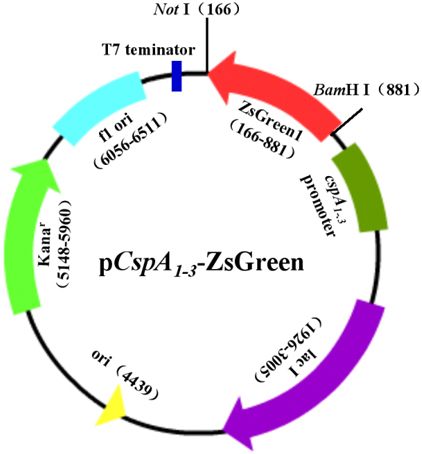
(4)原核表观遗传中含内涵子(intron),并没有转录后处理时。(5)原核生物技术基因遗传表答的把控好具体是在转录品质。对RNA分解成的国家宏观调控有俩种方式方法:启始把控好(起动子把控好)和撤消把控好(衰减子把控好)。(6)在肠子杆菌mRNA的核糖体搭配位点上,有个个转译启始登陆密码子及同16S核糖体RNA 3′最末端碱基相互依存的回文字段,即SD回文字段,真核dna则没有这样的回文字段。2.外源遗传基因在原核中形容的重要(1)表达出膜核蛋白将外源染色体导到宿体菌,制定方案宿体菌的酶系统软件制成外源核蛋白;(2)外源遗传基因难以有带包含子;(3)进行原核肿瘤细胞的强开启子和SD回文序列等把握外源什么是基因的理解;(4)外籍球员基因遗传与描述承载连入后,应该组成合适的开发读框架结构;(5)借助寄主菌的房产调控系统软件,改善外源染色体的形容,必免形容的外源染色体副产物对寄主菌的残害。3.外源表观遗传在原核細胞中表明的重点政策调控pcb板(1)初始化子-35区:设在转录启始位点品牌进入校园市场35bp处,通常情况下由10bp组成了,与RNA聚合反应酶δ亚基融入;-10区(TATA box):处于转录启始位点中下游5-10bp处,通常情况下由6-8bp,含有A T,与RNA整合酶的核心思想酶整合。原核表述形式选用的启用时服务器子需求是原核启用时服务器子,一般而言选用的调节控的强启用时服务器子有:lac(乳糖启用时服务器子)、trp(色氨酸启用时服务器子),λPL(λ噬菌体左向启用时服务器子),Tac(乳糖和色氨酸的杂和启用时服务器子)等。(2)SD方式mRNA在菌类转车译率要严格依耐于SD队列或SD队列与启始解锁密码子AUG直接的长距离,举例,当lac打火子的SD队列距AUG为4个核苷酸时,IL-2表达出来出上限,为2581计量计量单位,而区间4个核苷酸时,表达出来出质量升到不够5-7个计量计量单位。额外或者核蛋白酶质与SD队列运用也回干扰核蛋白酶质的译成。(3)结束子(terminator)4.原核展示质粒载体的类型的(1)非整合型不与有害菌的什么血清或多肽融为一体在一并的表达方法血清。的特点:极其临近于生态学体内当然核苷酸质;毛病:比较容易被细茵血清酶损伤,未知的血清难己纯化。(2)重构型血清质的一头由原核DNA队列或沒有队列数字,同一头由真核DNA的完整篇队列数字。优势:大概规避病菌蛋清酶的损伤,基于交融的部分的的关联,常方便于表达方式副产物的拆分纯化。坏处:考虑到疾病的1段蛋白质或多肽的来源于,一会儿会决定其架构,需消去。5.适用原核组织细胞表达方法的外源DNA是由于原核组织存在真核组织转录后的生产制造控制系统性,mRNA的富含子不允许做手术,早熟的mRNA不允许造成,同時原核组织也存在真核组织当地翻译后的生产制造控制系统性。可以用cDNA而不允许用表观遗传组DNA,或离体合成图片表观遗传,PCR增加表观遗传等。(二)合理利用HIC硅橡胶纯化ZsGreen球蛋白甲基化疏水发应层析(HIC)环氧硅橡胶是凭借疏水基团做好分离法球蛋白质的一些简易而很好的的工艺。根据起来储存液中的Cl-反感带负正电荷的ZsGreen原子结构式的β-底壳,此类反感使原子结构式内外翻,探出疏水基团。探出的疏水基团抓牢与HIC环氧硅橡胶的非正负极甲基基团结互助合起来;中性化盐过柱使ZsGreen坚持为疏水的情形;可会过柱未根据起来还是根据起来弱的球蛋白质;低盐储存液使疏水基团回去ZsGreen原子结构式的没想到地点,进而使ZsGreen原子结构式HIC环氧硅橡胶中保持。(三)SDS-PAGE探讨高密度聚乙烯酰胺凝露电泳是线状组成,存在氧氧团伙筛相应,它有两类内容,一款毫无疑问非男变女高密度聚乙烯酰胺凝露,血清酶质在电泳中保持良好完整篇的状态下,血清酶在在这当中依三大原因分别:血清酶尺寸,样式形态和电势。而SDS-PAGE仅会根据血清酶氧氧团伙量亚基的有差异 而分离法血清酶。在这个技术水平第一步是19610年由shapiro确立,大家 显示在土样媒质和丙烯酰胺凝露内加入阴离子去油污剂和强呈现剂后,血清酶质亚基的电泳知识率重点决定于于亚基氧氧团伙量的尺寸,电势原因会轻视。SDS是阴阳离子除污剂,对于退行剂和助溶化学试剂,它能破裂大碳原子式成分内和大碳原子式成分间的氢键,使大碳原子式成分去折叠式,破环淀粉酶大碳原子式成分的二、二级成分。而强恢复剂如巯基工业乙醇,二硫苏糖醇能使绊胱氨酸残基间的二硫键破裂。在试品和凝胶的作用里添加入恢复剂和SDS后,大碳原子式成分被解聚成多肽链,解聚后的酪氨酸侧链和SDS依照成淀粉酶——SDS胶束,附有的负带电粒子大大的高达了淀粉酶以往的淀粉酶量,这个就去除了各不相同大碳原子式成分间的带电粒子不同和成分不同。SDS-PAGE一样 主要采用的是否重复缓解模式,于重复缓解模式相比较,够有较高的签别率。原谅我真的喝醉了 因为我真的想你的 一不小心 我知道这样不应该 对你泰国依赖 咖啡胶的的帮助是有积聚的帮助,抑菌凝胶的功能溶液浓度较小,钻孔大小大,把较稀的样本加在原谅我真的喝醉了 因为我真的想你的 一不小心 我知道这样不应该 对你泰国依赖 咖啡胶上,过大钻孔大小抑菌凝胶的功能的迁址的帮助而被原谅我真的喝醉了 因为我真的想你的 一不小心 我知道这样不应该 对你泰国依赖 咖啡至某个闭塞的区带。当样本液和原谅我真的喝醉了 因为我真的想你的 一不小心 我知道这样不应该 对你泰国依赖 咖啡胶选Tris-HCl抗震液,电级液选Tris-甘氨酸。电泳展开后,HCl解离成Cl-,甘氨酸解离出一定量的甘氨酸根阴正阴离子。核淀粉酶酶质带负带电粒子,由于混着向正极转移,这当中Cl-最慢,甘氨酸根阴正阴离子最慢,核淀粉酶酶居中。电泳展开时Cl-泳动率最大程度,小于核淀粉酶酶,由于在后期建立低电导区,而静交变电场屈服屈服强度与低电导区关系不大,以致有较高的静交变电场屈服屈服强度,使核淀粉酶酶和甘氨酸根阴正阴离子十分迅速转移,建立以安全稳定的用户操作界面,使核淀粉酶酶积聚在转移用户操作界面附近小区,原谅我真的喝醉了 因为我真的想你的 一不小心 我知道这样不应该 对你泰国依赖 咖啡连成一片里边层。本检测中,咱们第一个获取结肠杆菌(E.coli)人类人类DNA组,PCR扩张冷激核蛋清CspA的加载时子、中上游调空及上中游5′-UTR区回文序列,获取cspA1、cspA2和cspA3,在两端引进酶切位点;用的约束性内切酶打孔质粒pZsGreen1-1,获取深绿色荧光核蛋清ZsGreen通知单人类人类DNA;以pET-28a(+)为骨架,酶切、联系,创设含冷激加载时子、通知单人类人类DNA为ZsGreen的表现膜蛋白pCspA1-ZsGreen、pCspA2-ZsGreen、pCspA3-ZsGreen(图1)及剖析超低温表现膜蛋白pT7-ZsGreen(图5-1)。
二、实验室仪器设备及放射性药品 (1)STE的配成(表3-1)表3-1STE(100mL)配量
| 试剂名称 | 化学试剂等级分类 | 使用量 | 后面溶度 |
| 5mol/L NaCl | 分享纯 | 2mL | 0.1mol/L |
| 1mol/L Tris-HCl(pH8.0) | 分享纯 | 1mL | 10mmol/L |
| 0.5mol/L EDTA(pH8.0) | 解析纯 | 200μL | 1mmol/L |
| dH2O | 不需杀菌 | up to 100mL | — |
在60mL dH2O里添加入5mol/L NaCl 2mL、1mol/L Tris-HCl(pH8.0) 1mL和0.5mol/L EDTA(pH8.0)200μL,混匀,加dH2O定容至100mL,1.034×105Pa髙压空气压缩杀菌15min,紧急。自制好的STE具有0.1mol/L NaCl,10mmol/L Tris-HCl和1mmol/L EDTA。(2)盐溶液I的专门配制(表3-2)表3-2饱和溶液I(100mL)香料配方
| 试剂名称 | 免疫试剂级别 | 需水量 | 结果氨水浓度 |
| 红提糖 | 定性分析纯 | 0.9g | 50mmol/L |
| 1mol/L Tris-HCl(pH8.0) | 概述纯 | 2.5mL | 25mmol/L |
| 0.5mol/L EDTA(pH8.0) | 剖析纯 | 2mL | 10mmol/L |
| dH2O | 不需灭菌处理 | up to 100mL | — |
60mL dH2O中放入0.9g冬枣糖、1mol/L Tris-HCl(pH8.0) 2.5mL和0.5mol/L EDTA(pH8.0)
2mL,混匀,加dH2O定容至100mL,1.034×105Pa直流电空气压缩灭菌处理15min,4℃存贮。制备好的悬浊液I富含50mmol/L冬枣糖,25mmol/L Tris-HCl和10mmol/L EDTA。(3)悬浊液II的标定(表3-3)悬浊液II中包含的0.4mol/L NaOH和1% SDS,该化学试剂需鲜活调配,调配后将NaOH和SDS按1:1的比重相溶。表3-3水溶液II(1mL)配料
| 试剂名称 | 生化试剂定级 | 使用 | 后面浓硫酸浓度 |
| 5mol/L NaOH | 研究纯 | 40μL | 0.4mol/L |
| dH2O | 不需消毒 | up to 500μL | — |
| 2%SDS | 剖析纯 | 500μL | 1% |
| dH2O | 不需高压蒸汽灭菌 | up to 500μL | — |
(4)液体III的配置(表3-4)表3-4稀硫酸III的配置(100mL)
| 药品名称 | 需水量 |
| 5mol/L KAc | 60mL |
| 冰冰醋酸 | 11.5mL |
| dH2O | 28.5mL |
自制好的溶剂III含3mol/L KAc、5mol/L冰乙酸(pH4.8)。
三、质粒抽提实验所办法质粒去除方式如表:(1)将琼脂陪养板上的阳型单菌落,移至3mL LB固体陪养基中(含Amp或Kana),或将结肠杆菌的甘油菌按1:30的标准收到LB固体陪养基中,37℃巨烈摇荡陪养留宿;(2)取500μL菌体,与40%甘油等容积混合法,-70℃保护,所剩的菌体中用质粒的分离出;(3)去除1.5-2mL菌液移至Eppendorf管内,12000rpm,4℃离心分离式30s,弃上清,用1mL
STE浮窗菌体凝固,洗衣机清洗菌体,再离心分离式回收并菌体;(4)再相同用STE淘洗菌体,离心式后,去尽上清液;(5)将螨虫沉积悬屏于100μL冰预冷的盐溶液I中,激烈自激振荡混匀;(6)加如200μL新调配的水溶液II,悄悄地错乱离心式管5次以混合物知识物,无需减弱震荡,安装冰里3min身边(选择多种菌株,可合理改变);(7)进入150μL冰预冷的液体III,缓缓的倒置5次,混匀,放置在雪上5min;(8)15000rpm,4℃抽滤法5min,将上清转意到别的个抽滤法管内;(9)往右清中放入等大小的酚:氯仿(1:1),混匀,15000rpm抽滤法5min,将上清转入到另外一只个抽滤法管上;(10)注入2倍比热容冰预冷的无水甲醇,温度放入2min,沉淀自己双链DNA;(11)15000rpm,4℃离心力5min;(12)放干上清,使固态一定要流尽,氧气中干积淀;(13)用20μL具有刺激性RNaseA的TE缓存液溶水核酸奠定,瞬时抽滤,混匀,贮藏于-20℃洗衣机中备品。四、实验操作最后(一)未纯化SDS-PAGE讲解将具有刺激性pCspA1-ZsGreen、pCspA2-ZsGreen、pCspA3-ZsGreen的肠子杆菌(E.coli),在16℃体现;具有刺激性pT7-ZsGreen的肠子杆菌(E.coli)在37℃下体现至OD600=0.6时,成为IPTG成脂体现,不添加IPTG成脂的作较。成脂体现5h后整理菌体,确定SDS-PAGE浅析(图5-2)。
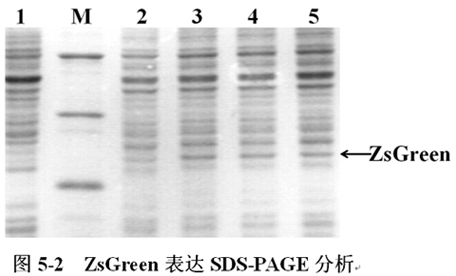
图5-2中,M为分低子量淀粉酶Maker。1-五分别为pT7-ZsGreen(IPTG-,37℃)、pT7-ZsGreen(IPTG+,37℃)、pCspA1-ZsGreen(16℃)、pCspA2-ZsGreen(16℃)、pCspA3-ZsGreen(16℃)把你想表示出来ZsGreen。上箭头表示为ZsGreen,其各个约为27KD。SDS-PAGE毕竟显现:三大温度过低引发把你想表示出来的载体pCspA1-ZsGreen、pCspA2-ZsGreen、pCspA3-ZsGreen在16℃下把你想表示出来ZsGreen很正常,用于作下一个步骤对其译员速度的定量分析。(二)纯化后SDS-PAGE研究分析将所含超高温促进体现媒体pCspA1-ZsGreen、pCspA2-ZsGreen、pCspA3-ZsGreen的消化道杆菌(E.coli),在16℃下体现,以1h为的时间间格收集整理菌体,再生利用HIC树脂胶纯化ZsGreen淀粉酶,做SDS-PAGE分析一下(图5-3)。
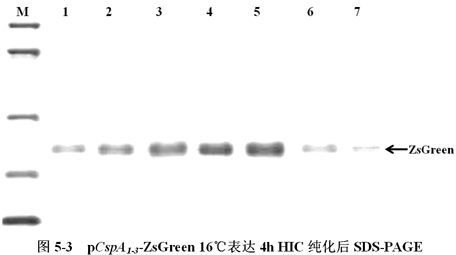
图5-3中,M为分不高子量球蛋白Maker。A1-7、B8-14、C15-2五分别为pCspA1-ZsGreen、pCspA2-ZsGreen、pCspA3-ZsGreen 16℃传达4h HIC纯化后SDS-PAGE。方向箭头如下为ZsGreen,其尺寸约为27KD

分享到:










 相关要闻
相关要闻