分析2000年至2014年FDA优先审评品种,优先审评究竟有何益处?截至2015年9月中旬,我国有数以千计的申请获得特殊审批资格,但特殊审批之于畅销药,又有多大的相关性?
美国是全球创新能力最强的国家,很多人都将这一现象归结于其制度、人才培养、知识产权保护以及强大的经济基础支撑等方面的优越性,还有美国国内庞大而灵活的私人及企业科技研发机构,带动了整个国家科技的蓬勃发展。在药物创新研发方面,美国也长期引导全球潮流,原因一是美国人骨子里非常崇尚的创新精神,二是政策方面也为发明和创造者提供了适宜的环境。
为了研制出能够战胜疾病的新药,不计其数的科学工作者耗费数年到数十年的时间在各自岗位辛勤工作,由此源源不断的新药注册申请送到了FDA手中。为加快药品审查,从1992年开始,FDA创建了审查时间两级系统(标准审评和优先审评)——优先审评(Priority Review)的周期为6个月,标准审评周期为10个月。通过增加人力物力的投入,优先审评类药物审评的速度得以提高。
要想获得优先审评资质的认定,申报的产品必须在安全性和有效性上产生显著改善或具有优于现有治疗手段的潜力,更方便或适用于更广泛的人群。与加速审批等不同,优先审评的特点只针对审评阶段,它既不改变审评标准,也不加速临床试验进程。但是,新药进入市场的时间缩短了,利于企业更快收回投资。
曾有研究数据显示,创新性程度越高的药品,取得的经济回报也越大。回望2000年至2014年FDA优先审评品种,哪些产品获得了巨大经济回报?而对于那些熟悉的畅销药物,优先审评有何益处值得考究。
法国:优先级审评药往往好销
畅销药的成因主要是药物特性、市场规律、企业营销实力及专利等,优先审评资格非主因
2000~201几年,拥有305个新品种拥有FDA的为先审评相关资质,这其中201几年应用较多,为35个,而排第二步位的日期要可追述200几年的29个;应用最高的是200半年,仅仅只有10个。
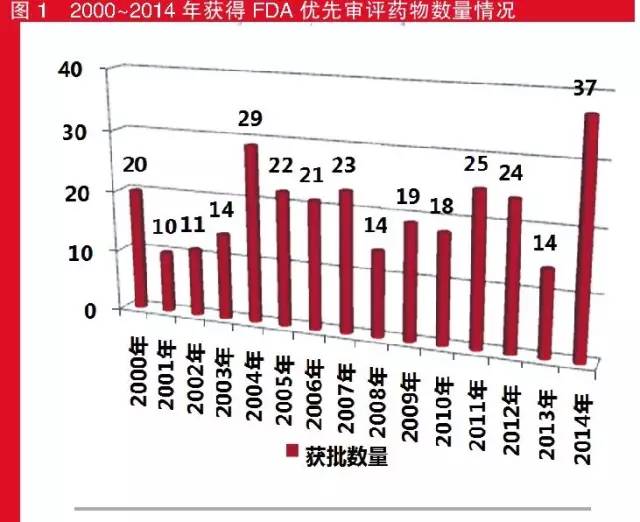
2010-201几年得到 FDA优先权审批权药剂个数事情
值得注意的是,在2006年至2008年间,由于艾滋病的泛滥,FDA临时性优先审评批准了20个治疗此类疾病的药物。
在获得优先审评资质的药物中,新分子实体(NME)占据了半壁江山。
既有优先级权审评又有弃婴药装备的“双获”口服药则是另外一只个非常值得大家关注的的现象。从需求量上看,优先级权审评口服药中新原子核实体化的和有弃婴药装备需求量最常的年号均为201五年,对应为19个和1七个;而从增长率方面看,新原子核实体化的需求量增长率最大的是2002年,弃婴药增长率最大的是201五年。6年间,有几个年号的NME将建需求量的增长率达到了四成,获弃婴药装备的口服药的增长率在201五年也相当50%,且这几年的时候(201五年例外)这类“双获”口服药的需求量均达到了2位数。
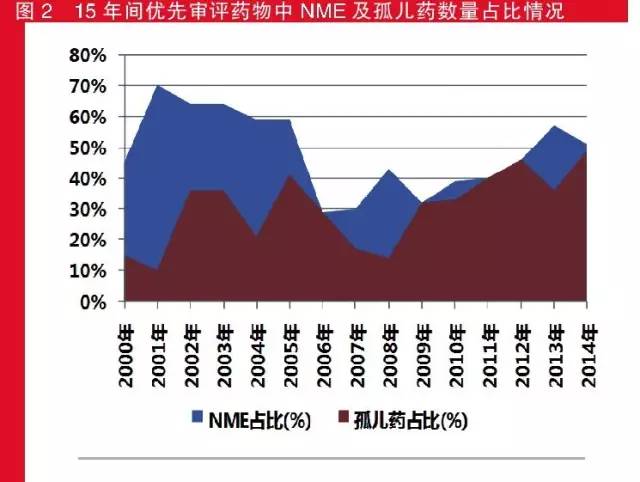
2015年间合理申批口服药物中NME及弃儿药量占有比率情形
追踪近些年来受市场追捧的超级畅销药可以发现,虽然有近三成的药物获得了优先审评资格,但超级畅销药最显著的特点却不是优先审批资格,而是它们的身份大多是新分子实体和新生物药,且大多属于制药巨头。
对市扬非常熟悉的超及受欢迎药参与收集整理,的结果界面显示,这在这其中近九成的药材为新团伙小平面和毕业生物药;从审评分类看,七八成的药材是进行常规化的标准的审评获准的,而其他的三成优先权审评药材中,新结合药材等获准的规模较少。而针对企业的产品的的归属于来讲,是更早的生产研发企业的是小子公司,最中企业的产品的的有了者均变成 了生物医药龙头企业。除此其它,国家申请从而导致的市扬占有以其国家申请届满后呈现的断岩式市场股票下跌也为在业内掌握。
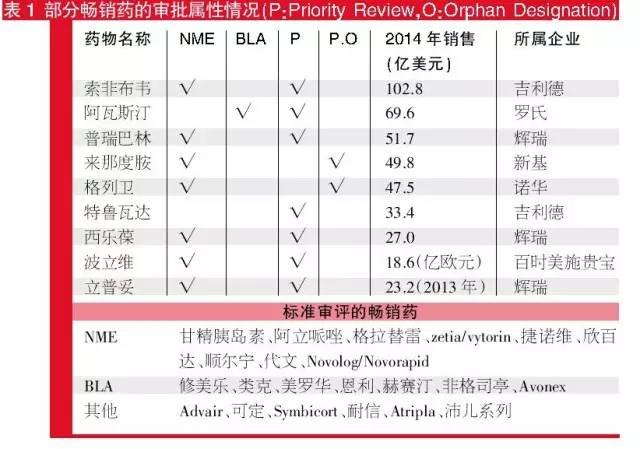
位置长久药的审批权状态症状
因而可以看出,畅销药的成因最重要还是药物特性、市场规律、企业营销实力及专利等,优先审评对产品的推动有作用但非主因。
国内 :特殊的审批权不属于凡事大吉
获得特殊审批资格不等同于批准上市,且对销售业绩的推动力量有限
在我国,因审评人员短缺等原因暂无此类优先审批和标准审评的划分,但对新药和仿制药等审评时间做了有关规定。为鼓励研究创制新药,有效控制风险,CFDA于2009年颁布了《新药注册特殊审批管理规定》。根据相关规定,CFDA对未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂,新发现的药材及其制剂;未在国内外获准上市的化学原料药及其制剂、生物制品;治疗艾滋病、恶性肿瘤、罕见病等疾病且具有明显临床治疗优势的新药;治疗尚无有效治疗手段疾病的新药注册申请实行特殊审批。药品审评中心在收到特殊审批申请后分别会在5日或20日内进行审查确定,而现场核查、检验的部门对于获准特殊审批的注册申请也会予以优先办理。
截至2015年9月中旬,国内有数以千计的申请获得了特殊审批的资格,其中绝大多数为一类新药,少数为其他类别。药物类型以化药为绝对主力,占比超过九成;而其中1.1类新药的申请数量超过五成。中药虽占比不大,但市场销量较大的银杏类药物的有效单体银杏内酯B位列其中。生物药占比也不大,但是包括重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白等制剂也已经获得了生产批文。而在获得特殊审批资格的企业中,外企占比近四成,国内企业中江苏恒瑞申请数量占比接近10%。
是否获得特殊审批的资格就万事大吉呢?其实不然。首先,该资格不会增加药品通过审评的筹码。其次,药品销售情况与诸多因素相关联,此单一因素非畅销保障。数据显示,审评通过方面出现“他司曲洛”等多种药物审批结论为“不批准”;还有“五羟黄酮”等药物为“退审”和“终止审评”等。因此,获得特殊审批资格不等同于批准上市。
从销售业绩的角度来看,2011年获批上市的以治疗风湿等为主的艾瑞昔布,虽贵为1.1类化药且为江苏恒瑞所拥有,并自上市后销售以数倍计的方式增长,但2014年其销售只占到抗炎抗风湿类药物总和的千分之三,就算缩小范围以昔布类来计,也只占到昔布类的1.5%,而销售最好的帕瑞昔布占到昔布类的56%。同为2011年批准的埃克替尼的数据就好看得多,2014年1.1类治疗肿瘤的化药埃克替尼的销售排在替尼类销售的第四位,占到替尼类销售总量的13.4%,但从国内抗肿瘤药总销量来看,埃克替尼也仅占到1.2%,离畅销药还是有些距离。










 相关内容要闻
相关内容要闻