



中国:
Email: marketing@czchengteng.com
销售业务咨讯专线电话:400-780-8018 (仅供提供服务了解和咨询,的事项请加拨川沙总公司热线) 川沙公司总部联系方式: +86 (21) 5859-1500海外:
+1(781)535-1428(U.S.) 0044 7790 816 954 (Europe)Email:marketing@medicilon.com



对于抗肿瘤新药研发公司来说,了解和掌握药监部门否决相关新药上市申请的原因,设计更加合理完善的临床试验方案和临床结局指标,将有助于提高新药上市申请的批准的可能性。
想要熟悉美利坚FDA被否抗癌肿新原子实物性性口服药物剂量抗癌性性口服药物什么时候退市报考办理的的原由,美利坚FDA医疗药品审查中心站的控制人数设计问卷调查了2003年三月份17日到2010年三月份17日这三十年间,向美利坚FDA递交的抗癌肿新原子实物性性口服药物剂量抗癌性性口服药物什么时候退市报考办理的贷款审核情况下。对美利坚FDA被否的抗癌肿新原子实物性性口服药物剂量,完整理论研究了抗癌性性口服药物什么时候退市报考办理被拒决的深层次的原由,以便对从事于抗癌肿新原子实物性性口服药物剂量研发部门的工厂提高参照。
一、2005-2015年抗肿瘤新分子实体药物新药上市申请被否决概况
2018年2月17日到2010年2月17日这三十年间,总计有13个抗癌症新分子式小平面药品的抗癌用量销售公司申请办理被否定。按照抗癌用量销售公司申请办理被否定毕竟的不相同,科研课题专业人员将抗癌用量划分出两种类:1)可行性不佳的抗癌用量(10个抗癌用量,占基本药品的67%);2)临床治疗实验室检测的设计现实存在通病的抗癌用量(3个抗癌用量,占基本药品的33%)。 如果没有药品毕竟人身可靠性方面而没办法在FDA申批。
表 2005-20十五未在美利坚FDA报备抗良性肿瘤新氧分子实体型中成药成功上市提交申请理由数据分析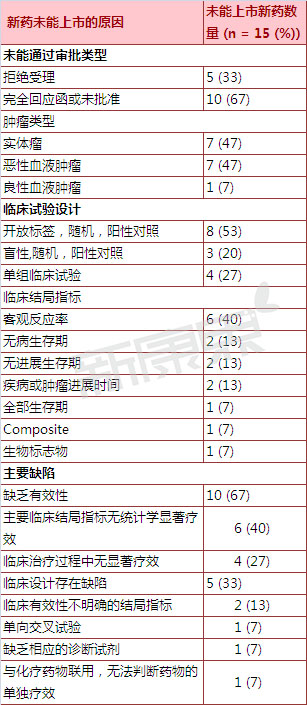
二、10个抗肿瘤新分子实体药物的新药申请因有效性问题而被FDA否决
10个抗肿癌新分子式线下实体药的仿制药挂牌上市公司申办为了行之高效性现象而被FDA坚决反对,当中6个仿制药为了关键临床检验结尾是什么核算因素无核算学正相关成效而被FDA坚决反对,这样公司申办人如果想荣获仿制药批复,最好的对亚组的参数仔相关性分享析结尾是什么核算因素,如从受试者地理位置分布不均、病患者优势特点、不一样的根治期等因素分享结尾是什么核算因素的区别。
其它4个抗癌仿制药因临床试验检验控制控制成果不强势而被FDA否定。中仅俩个抗癌仿制药实施的随机函数试验检测台中,总之控制成果强势,仅是与剖析药品较之长处不特别。 其它俩个抗癌仿制药实施的单组临床试验检验控制试验检测台,因出具的客观性解决率统计资料不佳以表现形式临床试验检验控制药用价值为此被FDA否定。
三、5个抗肿瘤新分子实体药物的新药申请因临床试验设计存在缺陷而被FDA否决
3个抗良性肺部良性肿瘤新原子企业口服口服性药物的抗癌口服性药物个人申请因临床药理研究药理控制实验室检测实验实践实验来构思来构思有着瑕疵而被FDA坚决反对,这之中俩个抗癌口服性药物因选择的临床药理研究药理控制实验室检测实验实践结局是什么指标值不不错的反映了口服口服性药物的冶辽效率而被FDA坚决反对;第5-7个抗癌口服性药物落实的是国际上多核心临床药理研究药理控制实验室检测实验实践实验来构思,选择一专多能冶疗口服口服性药物为参考。犹豫在钻研该抗癌口服性药物对的不同各国爱美者的辽效时选择的是单线平行实验来构思,故而被FDA看做有着临床药理研究药理控制实验室检测实验实践来构思瑕疵而被坚决反对。第4个抗癌口服性药物落实的是单组临床药理研究药理控制实验室检测实验实践实验来构思,推行的是良性肺部良性肿瘤引发不同型基因变异的爱美者。其实犹豫在临床药理研究药理控制实验室检测实验实践是沒有合适的检测生物学药品鉴定选调出合适的良性肺部良性肿瘤爱美者,故而被FDA坚决反对。第5-7个抗癌口服性药物落实的是用独立临床药理研究药理控制实验室检测实验实践实验来构思,在吃完该药后爱美者再落实生物学冶疗,犹豫不不错的原因分析该药的用独立辽效因其被FDA坚决反对。
四、小结
抗淋巴癌症药物的备案整体认为往上走就说个优势-危险均衡性的环节,国家药品监督管理局部们必须要 总体要考虑药物的安全的性动态数据文件、有效地性动态数据文件、淋巴癌症的复发率、问题的威害系数、求美者可选择择的使用药物性质、药学对新调理办法业务需求的急切需要系数等方上面的基本要素。我们对抗淋巴癌症药物创新公司的认为,控制和控制国家药品监督管理局部们坚决反对相应的药物销售申請的原由,设计制作会更加科学成熟的的药学试验装置实施方案和药学下场的指标,将促使提升 药物销售申請的批复的情况性。
 一些最新报道
一些最新报道