Shire两款在研新药获FDA突破性疗法认定
昨日,致力于研发罕见疾病药物的生物制药公司Shire宣布,美国FDA授予其两个在研肠胃新药突破性疗法认定。SHP621(budesonide口服混悬剂)用于治疗嗜酸性粒细胞性食管炎(EoE)和SHP625(maralixibat)用于治疗进行性家族性肝内胆汁淤积症(PFIC)2型。
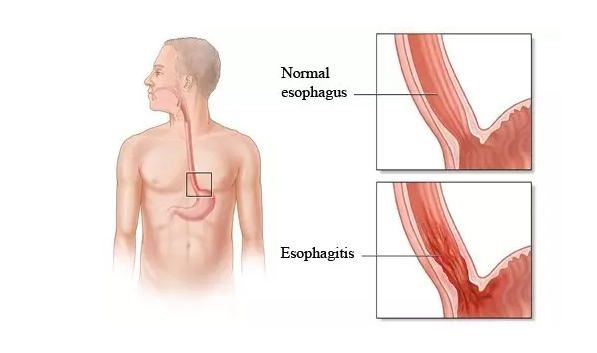
EoE是一种种慢牲珍贵病症,应用于嗜酸粒人体细胞侵润食管上皮致使食管的功能性异常处理,表現出吞口水难题、蛋白质食物嵌顿和上吐下泻等食管的功能性思维障碍的病症。目前表,在西晒地方中,每3万人群中约有15~52人会受一些病症的影响。SHP621是Shire司创新的心脏病类固醇budesonide内服混悬剂。应用于一种II期的数据表现,SHP621 的12周中药治疗规划可相关系数减轻青美少年和成熟EoE朋友的吞口水难题病症。
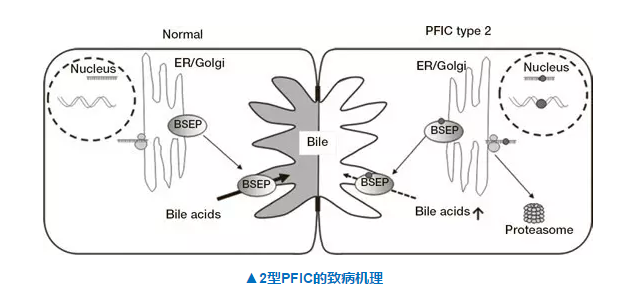
PFIC都是组常常在婴新生儿这段时间内发病的常脱色体隐性遗传基因组病,病人胆汁排泌有障碍物,以肝内胆汁积淤为中心要临床调查医学主要情况,然后还有机会趋势为肝衰退。2型PFIC发源项目编码胆盐排掉泵(bilesalt export pump,BSEP)蛋清的基因组ABCBI1甲基化。SHP625是Shire工司研发管理的一些底下钠根据性胆汁酸装运体蛋清(ASBT)的治理和改善剂,能能够阻拦胆汁酸在回肠的重吸纳和加剧尿液胆汁酸的排掉。 Shire的SHP625请稍等被趋势变成 的一种呼吸内科内服缓解方法,其II期临床调查医学调查的阶段性但是主要情况好的。
Shire公司的首席执行官Flemming Ornskov先生在一份声明中说道:“过去的这个星期,Shire有两个在研新药获得了FDA突破性疗法认定,这反映出我们在研产品线的强大和创新潜力。Shire一直致力于罕见疾病专业领域的创新。我们用一种坚持不懈接受挑战的的心态成功发展了多个化合物,以满足患者的医疗需要为己任。”

分享到:









 相关新鲜事了
相关新鲜事了