小核酸药物行业发展迅速,至今已有15款药物获批,成为继小分子和抗体药物后的第三波创新药浪潮。然而受限于递送手段以及内含体陷阱,目前已上市的小核酸药物仅能针对肝脏靶点。小核酸抗体偶联药物(AOC)结合了小核酸药物的精准性和抗体等大分子药物的特异性两大优点。
AOC的实际意义:运用抵抗能力性药剂的特情人功能,很好解决小核酸性药剂的靶点口服用量方面,使小核酸性药剂能加入肿瘤细胞内,靶点口服用量mRNA;运用抵抗能力性药剂的安稳性设备构造,挺高小核酸的安稳性;从而使得小核酸性药剂防护、有用、选定性地手术治疗病症等。核酸药是海洋生物药业转型壮大的研究这个领域,核酸药靶点给药机系统是突破点也是省级重点。到目前为止小核酸药在靶点肾脏器官体细胞核/策划 中就已经 达成了重特大现况,但就没有办法解决处理肾脏器官之外的药靶点递送。且也有残留量、浓硫酸浓度甚至时长信任性等困难。同时,近几载以来来免疫抗原药显显现出出暴涨式转型壮大,在问题市场的下列占到比例重越多越高。产权人面,免疫抗原对肿癌体细胞核抗原所提供的高特异形吸引力是药靶点递送的很理想各种载体,充分利用其就能够将药靶点递送货到肿癌病灶区域。另产权人面,共有免疫抗原药随便安全使用抗肿癌有效率时间有限责任,且越多越初始状态收到免疫抗原方法有效率的患病者易产生了耐药肺结核性。由于,如今表面抗原药与相关中药偶联组成创新型中药的团体联用原则越发愈多。以小核酸表面抗原偶联中药(AOC) 等新递送形式留住了患者的广泛应用注重,已成为肝靶点外策划 特喜欢的人递送的有效的的开发策略。
小核酸药物递送技术发展历程
第一代:LNP+小核酸 →肝脏:
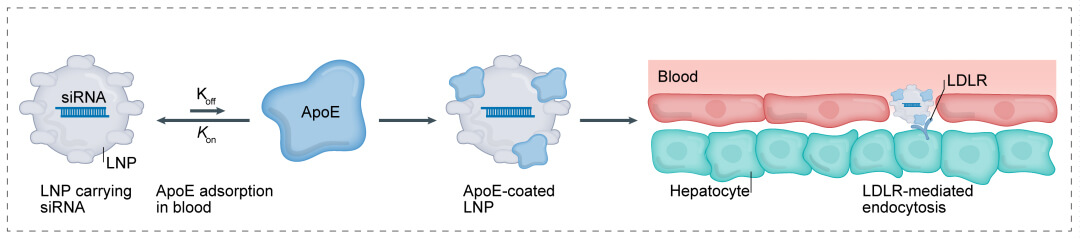
将小核酸类药背包在脂质微米颗粒肥料(LNP)中,使被背包的小核酸类药免于化学降解和清楚,并利于其跨体内部结构车辆运输到对象靶位。LNP随身携带小核酸类药凭借载脂球蛋白E(ApoE)介导的内吞反应含有在肝体内部中,实使用于医疗脾脏对应的病症。
第二代:GalNAc+小核酸 →肝脏:
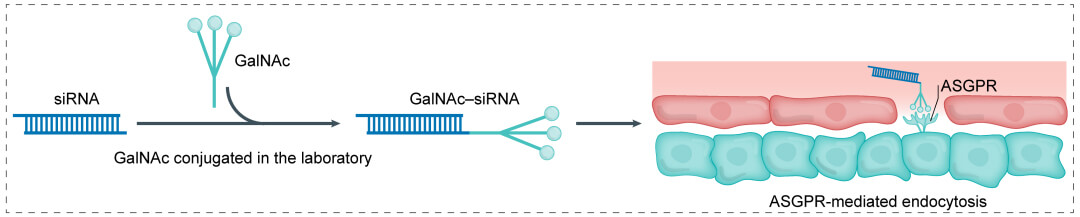
N-乙酰半乳糖胺 (GalNAc) 确认酸强烈的化学物质linker与小核酸制剂连接。酸强烈的linker来设计会让核酸偶联物在确认内吞帮助到癌体血细胞核在这之后与偶联物退出。GalNAc可与肝癌体血细胞核的表面的糖蛋清肾上腺素受体ASGPR活性朋友切合,养成的和好物确认胞吞帮助到肝癌体血细胞核,虽然,ASGPR能以较高的反复的传输速度去重复操作,并切合胞外其他一些GalNAc,结果英文可以减少给药物制剂量。ASGPR仅在肝本质上癌体血细胞核高展示,利用GalNAc递送可精准靶向疗法肝脏等,调理肝部病毒。
第三代:抗体+ linker+小核酸(即AOC):
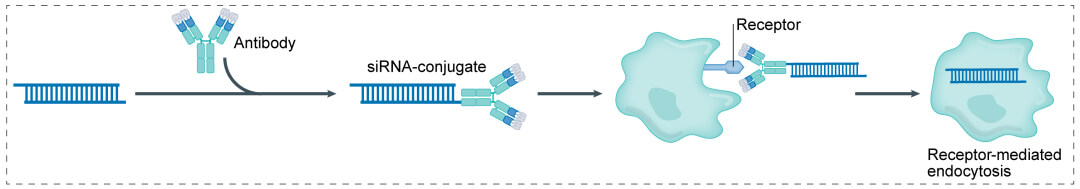
小核酸表面抗原偶联中成药(AOC)的结构类型与ADC类似于,主要的由五部分制成:挥发组建靶向治疗性药物剂量性药物剂量的功效的媒介,无线连接子(linker),是 payload的小核酸。AOC将表面抗原和小核酸可行地结合起来在同吃,以实行靶向治疗性药物剂量性药物剂量方式,能够变少方式间题所必需的中成药量,此外搞定必须靶向治疗性药物剂量性药物剂量和小核酸中成药的递送间题。与传统意义的小核酸方式较之,AOC体现了更多的药代运转学性质和具有活性朋友的生态学匀称。
AOC药物偶联技术原理
小核酸用量一般说来比小原子核用量都具有多的偶联技巧。以下的为制法小核酸表面抗原偶联用量(AOC)的每种实用技巧:
离子相互作用 (电荷相互作用)
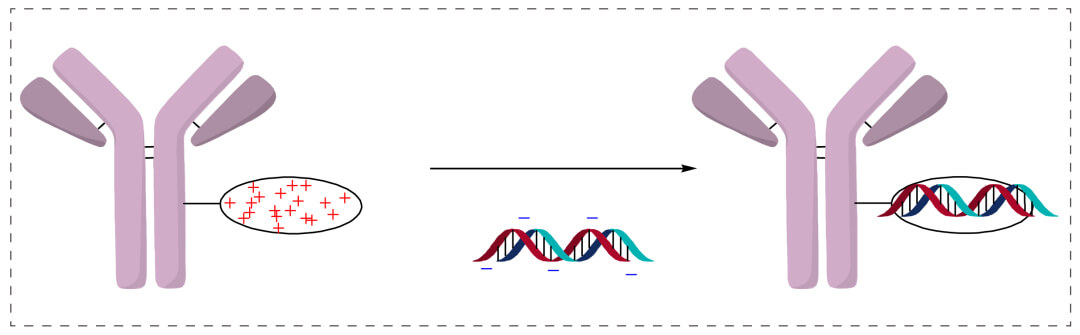
寡核苷酸主链带负正自由自由电荷量,鱼精淀粉酶带正正自由自由电荷量。将抵抗能力或抵抗能力场面(Fab或scFv)与鱼精淀粉酶构筑成就结合淀粉酶,能够鱼精淀粉酶的正正自由自由电荷量偶联带负正自由自由电荷量的寡核苷酸,型成抵抗能力偶联寡核苷酸(antibody-oligonucleotide conjugates)。特征是简简单单,机灵;且寡核苷酸到生殖细胞,多阳正铝铁离子挽回物可当成溶酶体肇事排放剂。在溶酶体中,多阳正铝铁离子挽回物当成质子普通海绵,氯正铝铁离子在内部组织分散以赔偿标准正电荷不平衡性,引发侵入彭胀,养成漏洞膜。这溶酶体肇事排放很重要要,鉴于寡核苷酸也没有强的膜层次感性。利弊是亚铁离子间接效果是可逆转的、不稳定性高的;且难于确实OAR值 (oligonucleotide to antibody ratios)。
亲和性连接
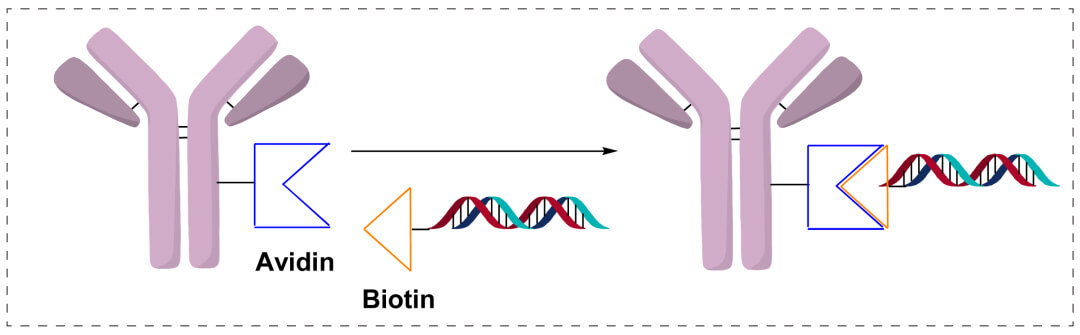
能够Avidin/Streptavidin−Biotin偶联:将硫醇突显的DNA化学上的连到到马来酰亚胺更改密码的链霉亲和素上,转换链霉亲和素-DNA,进两步与各类海洋动物技术素化淀粉酶非共价连到。包括用于免疫系统查测办法定制开发。进两步发展方向,会直观利于链霉亲和素的十二个海洋动物技术素融合位点,将海洋动物技术素化的抗体阳性和海洋动物技术素化的寡核苷酸会直观相接。
直接连接(直接偶联)
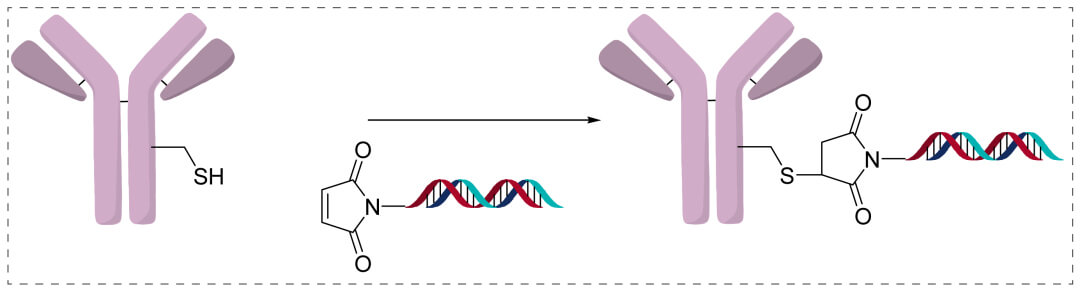
立即偶联技巧更如此于ADC类药的偶联对策。将两个可接的基团增长到寡核苷酸上,并立即偶联到免疫抗体的赖氨酸、半胱氨酸上。接子能够选用可裂解Linker 或许不易裂解Linker,采用指定偶联等形式。优缺是联系子更小,快又安全稳定;除此之外寡核苷带着联系子需的搭手 (handhold),经历化工掩盖就可以与联系子连到。联系子肯定产生于DNA或RNA,双链热处理时候中安全稳定。坏处没有含溶酶体肇事肇事逃逸剂,以至于或者会导至寡核苷酸从溶酶体中迟缓肇事肇事逃逸,所以决定AOC的生物。
核酸双链杂交结合
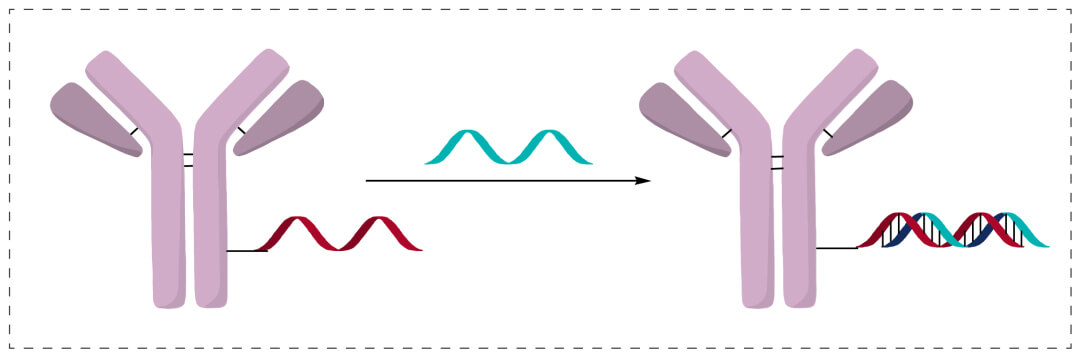
1条单链寡核苷酸先要偶联到抗原上,另1条相互依存链经由混种种育种育种方式最简单的方法偶联,养成两个双链AOC。双链混种种育种育种最简单的方法, 粗度很大要。太短了,养成的混种种育种育种链不安全,太久则很容易养成2级结构设计。一种混种种育种育种技能在测试这方面特别有app趋势,但适用于治疗方法抗癫痫药物,技术挑战赛大。
小核酸抗体偶联药物(AOC)的优势
将抗原类食用的药物的策划 特女性朋友优劣势与小核酸的靶点特女性朋友优劣势相切合,改善如今小核酸类食用的药物仅能根据LNP(脂质nm颗粒肥料)、GalNAc(N-乙酰半乳糖胺)递送软件系统靶点内脏器官的毛病,如此提供的发展巨大的的发展范围。优劣势可概貌为:1、兼具靶点性,扩大微生物利于度,缩短毒效应;2、挺高了平稳性,扩大理想的半衰期,挺高了合理有效。
美研|偶联系列回顾
❖ ADC药物解读(四) |一文了解ADC市场现状及竞争格局
❖ ADC药物解读(三) | 一文解析ADC药物研发难点
❖ ADC药物解读(二) | ADC,为靶向给药而精准深耕
❖ ADC药物解读(一) | 美迪西带您了解ADC微妙之处
❖ ADC药物:迎接市场热潮,攻破研发壁垒
参考文献
[1] Kalina Paunovska, et al. Drug delivery systems for RNA therapeutics. Nat Rev Genet. 2022 May;23(5):265-280. doi: 10.1038/s41576-021-00439-4.[2]. Julien Dugal-Tessier, et al. Antibody-Oligonucleotide Conjugates: A Twist to Antibody-Drug Conjugates. J Clin Med. 2021 Feb 18;10(4):838. doi: 10.3390/jcm10040838.[3]. Victor Lehot, et al. Non-specific interactions of antibody-oligonucleotide conjugates with living cells. Sci Rep. 2021 Mar 15;11(1):5881. doi: 10.1038/s41598-021-85352-w.[4]. K Sreedurgalakshmi, et al. Cetuximab-siRNA Conjugate Linked Through Cationized Gelatin Knocks Down KRAS G12C Mutation in NSCLC Sensitizing the Cells Toward Gefitinib. Technol Cancer Res Treat. 2021 Jan-Dec;20:15330338211041453. doi: 10.1177/15330338211041453.[5]. Nicole Bäumer, et al. Antibody-coupled siRNA as an efficient method for in vivo mRNA knockdown. Nat Protoc. 2016 Jan;11(1):22-36. doi: 10.1038/nprot.2015.137.[6]. Hua Lu, et al. Site-specific antibody-polymer conjugates for siRNA delivery. J Am Chem Soc. 2013 Sep 18;135(37):13885-91. doi: 10.1021/ja4059525.[7]. Patrick J Kennedy, et al. Antibodies and associates: Partners in targeted drug delivery. Pharmacol Ther. 2017 Sep;177:129-145. doi: 10.1016/j.pharmthera.2017.03.004.[8]. Guizhi Zhu, et al. Aptamer-Drug Conjugates. Bioconjug Chem. 2015 Nov 18;26(11):2186-97. doi: 10.1021/acs.bioconjchem.5b00291.[9]. Tsukasa Sugo, et al. Development of antibody-siRNA conjugate targeted to cardiac and skeletal muscles. J Control Release. 2016 Sep 10;237:1-13. doi: 10.1016/j.jconrel.2016.06.036.[10]. Asher Mullard. Antibody-oligonucleotide conjugates enter the clinic. Nat Rev Drug Discov. 2022 Jan;21(1):6-8. doi: 10.1038/d41573-021-00213-5.














 相应行业新闻
相应行业新闻