2006 年诺贝尔奖花落siRNA药物,2018年全球首款siRNA药物获批,2020年首个mRNA疫苗获批上市等等,这些都让世人看到核酸类药物的巨大潜力。核酸药物作为继小分子化药和抗体药物后的第三大类型药物,在全球已经形成燎原之势,发展势头迅猛,成为生物医药企业研发的重点和热点。核酸药物研发速度极快,靶向性高,有望突破传统药物无法解决的“不可成药”的靶点。与此同时,核酸药物的研发及工艺壁垒高,药物于免疫系统的作用机理尚未完全清晰,递送和专利修饰保护极其复杂。当前,核酸类药物领域进入空前蓬勃发展的历史时期。
核酸药物概述
核酸药物是指利用核酸分子的翻译或调控功能对疾病进行干预的药物。与传统的小分子药物和抗体药物相比,核酸药物能够从源头进行干预,抑制疾病相关基因表达为病理性蛋白,或引入能够表达正常蛋白的基因弥补功能蛋白的不足。
寡核苷酸药物是由人工化学合成的寡核苷酸单链或双链组成的一类药物,通过碱基互补配对作用于mRNA,干扰基因的解旋、复制、转录、mRNA 的剪接加工乃至输出和翻译等各个环节,使编码异常的基因丧失功能,进而阻止“错误”蛋白质的表达,从而发挥基因水平上调控疾病基因转录翻译过程的独特机制。
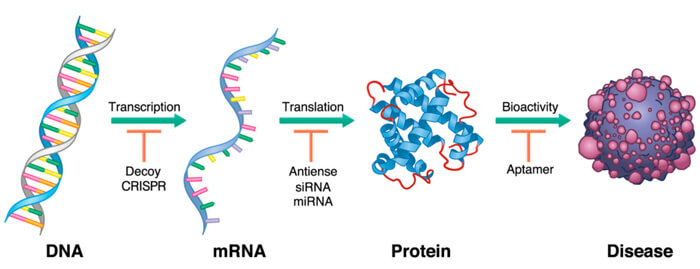
寡核苷酸药物作用于病理基因表达的不同阶段[1]
核酸药物分类
核酸药物可主要分为寡核苷酸药物和mRNA两大类。代表性寡核苷酸药物主要包括反义寡核苷酸(ASO)、小干扰 RNA(siRNA)、微小 RNA(miRNA)、小激活RNA(saRNA)、核酸适配体 (aptamer)和转录因子诱饵(decoy)、核酶(ribozyme)等。其中ASO和siRNA类型的寡核苷酸药物应用广泛。
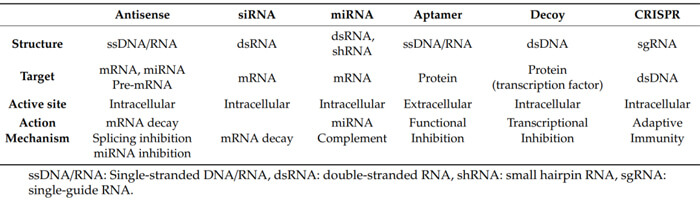
寡核苷酸药物分类[1]
全球寡核苷酸药物发展现状
近年来,随着相关研究和技术的进步,核酸药物迎来快速的发展,全球上市的核酸药物数量逐年递增,截至目前全球共有17款核酸药物获批上市。包括 15 款寡核苷酸药物 (3款已经退市)和 2 款 mRNA 产品 。15 款获批上市的寡核苷酸药物包括9款ASO药物、5款siRNA药物和1 款核酸适配体。
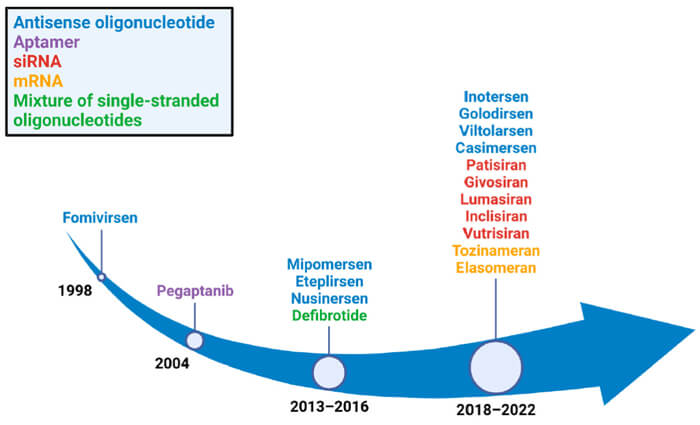
已获批的核酸药物[2]
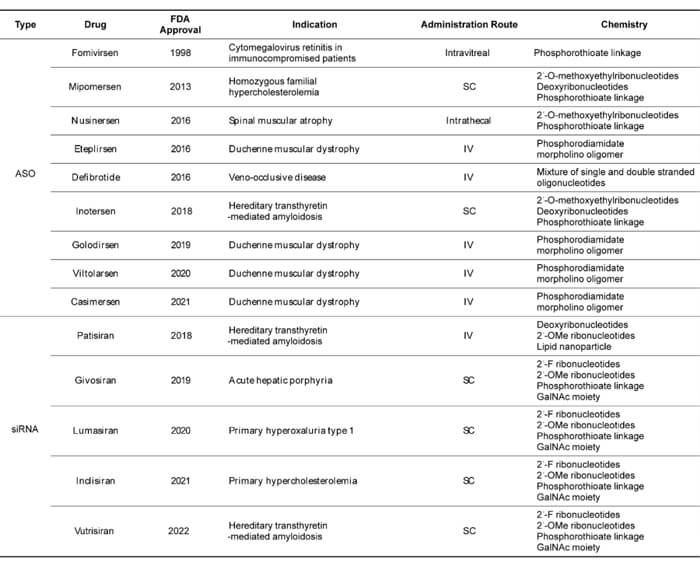
已获批的寡核苷酸药物 (截至2022年6月)[2]
与国外相比,国内目前还暂无获批的寡核苷酸药物,国内的寡核苷酸药企业目前都还处于发展初期或者上升期。国内企业中寡核苷酸药物的领先企业包括艾博生物、瑞博生物、圣诺制药、中美瑞康等。
全球寡核苷酸药物适应症分布广泛,包含了肿瘤,遗传病性疾病,心血管系统疾病,新陈代谢疾病等多个疾病领域。肿瘤和遗传性疾病病是临床管线的适应症中占比最多的。
寡核苷酸药物作用机制
RNA干扰(RNAi)
RNAi 是指长双链RNA被剪切为短双链RNA 后,与蛋白质结合形成siRNA 诱导干扰复合体(RISC),短链RNA的正义链降解后,RISC再与特定mRNA结合, 使mRNA降解,最终沉默相应基因的表达。这是一种高度保守的过程。
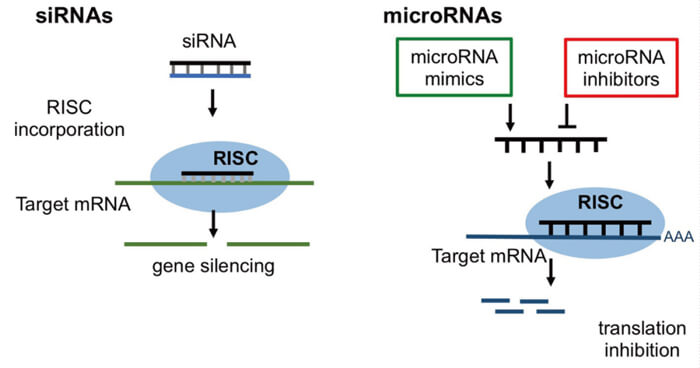
RNAi的作用机制[3]
反义寡核苷酸 (ASO)
ASO是指与靶基因mRNA互补的一段单链DNA或RNA序列,通常由十几到几十个碱基组成,通过化学合成的方式生产。对ASO进行某些特定的化学修饰后,ASO药物通过一定方式进入细胞,能够特异性地调控靶基因的表达。ASO靶向细胞内各种类型核酸(pre-mRNA、mRNA、非编码 RNA)。ASO 主要通过刺激 RNAase H 活性来抑制蛋白质生产,这反过来又会导致靶 mRNA 降解(ASO“Gapmers”)。
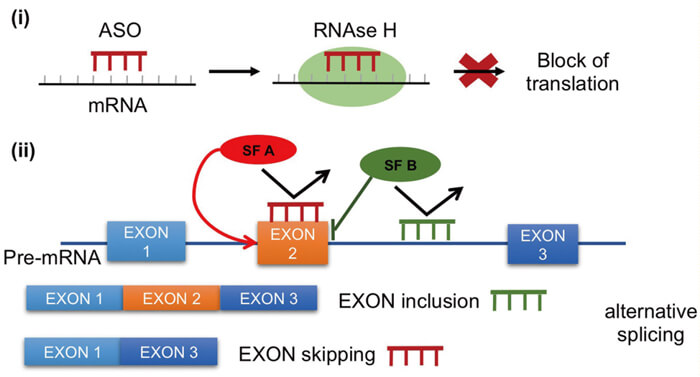
ASO 药物作用机制[3]
核酸适配体 (nucleic acid aptamer)
核酸适配体是通过大型寡核苷酸文库(称为SELEX)筛选的单链DNA或RNA分子,以高选择性和特异性结合特定靶点。常见的靶点包括小金属离子和有机分子、蛋白质、病毒、细菌和整个细胞。靶点识别和结合涉及三维、形状依赖性的相互作用以及疏水相互作用。下图是适配体Pegaptanib通过与其受体VEGFR结合来抑制靶蛋白VEGF-165作用的示意图。
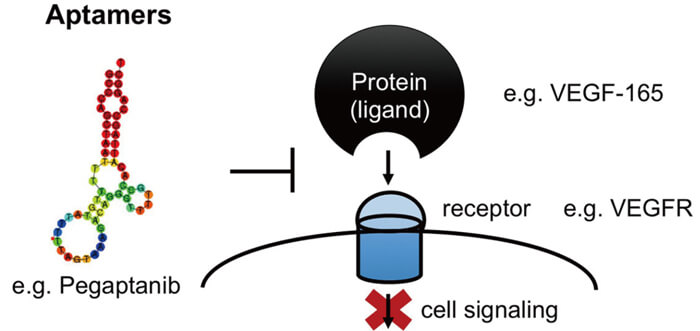
核酸适配体的作用机理[3]
寡核苷酸药物优势
❖ 特异性强:寡核苷酸药物是根据目标RNA人工设计的,所以目标明确,靶点特异性强。
❖ 设计简便、研发周期短:寡核苷酸药物临床前研发首先通过测定基因序列,针对疾病基因进行合理设计,使基因靶向沉默,所以能避免盲目开发,很大程度上节省研发时间。
❖ 靶点丰富:寡核苷酸药物从转录后水平进行治疗,能针对一些蛋白靶点能有疗效的特殊靶点进行突破,有望攻克尚无药物的遗传疾病。
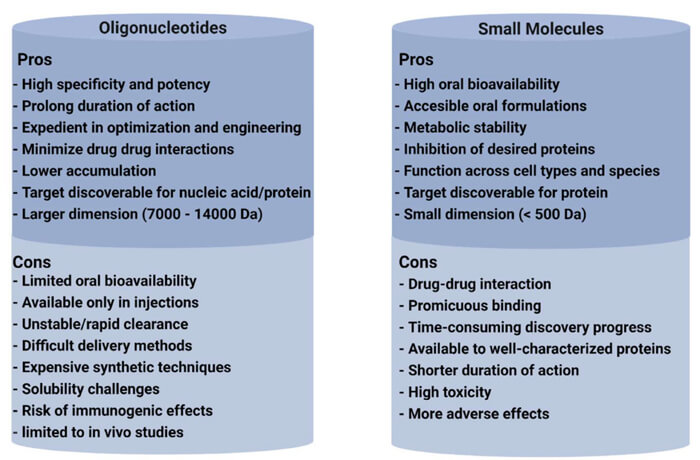
寡核苷酸与小分子药物的优缺点比较[4]
寡核苷酸药物开发挑战和策略
寡核苷酸原料药生产使用固相合成技术,在工艺开发、工艺放大和质量控制上存在较高壁垒,寡核苷酸原料药固相合成配套设备、洁净环境等前期投入非常大,同时生产需符合 GMP要求。因此,国内有能力生产寡核苷酸原料药的企业较少,相关产业配套尚不完善,随着市场需求的增加,能否保证寡核苷酸药物的及时供应成为产品开发和商业化成功的重要挑战。
核酸药物合成&修饰:
美迪西
核苷酸药物化学合成平台可以一站式提供单体合成、修饰;寡核苷酸合成;递送系统合成以及寡核苷酸偶联物的合成。已经建成的siRNA库,不仅有丰富的单体库存,而且拥有庞大的单体合成砌块库,可以快速完成各类修饰单体的合成。美迪西拥有专业的小核酸药物的研发团队可以提供高效快捷地研发服务;已有多个siRNA药物
FTE项目完成和进行中。
核酸药物CMC研究:
寡核苷酸药物开发过程中药学方面的挑战主要是寡核苷酸大规模生产能力和分析与质控能力要求高,大规模生产对单体原料,设备,合成工艺及纯化方面都有很高要求。制剂方面的挑战在于制备LNP(GalNac技术的小核酸除外)的难度高;分析方面挑战在于寡核苷酸的有关物质与活性成分本身的结构相似性大,质量研究与控制需要多原理不同手段的分析方法进行,除了一般注射剂研究外还要进行LNP的包封率测定等。美迪西在siRNA等寡核苷酸药物方面的CMC服务项目已启动。
核酸药物药效学评价:
寡核苷酸药物开发过程中药效学方面的挑战包括:靶向不足导致靶部位的寡核苷酸药物浓度低导致给药剂量不断增高;寡核苷酸药物与非靶 RNA 结合引发的脱靶毒性等。
美迪西案例:核酸药物药效学评价
❖ 不同用药途径的比较(如静脉注射,瘤内局部注射)
❖ 体内药效与靶标mRNA/蛋白质降解(PD)和寡核苷酸药物的系统暴露量(PK)的相关性分析
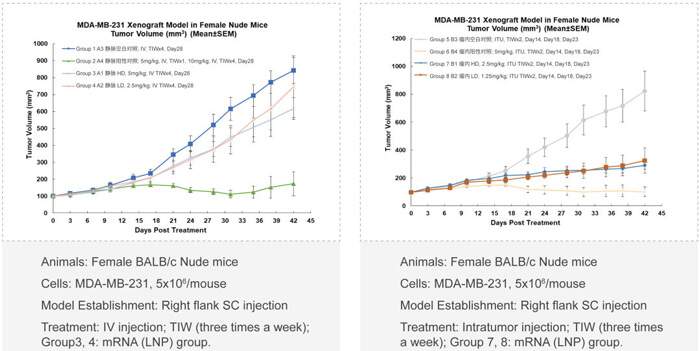
核酸药物生物分析:
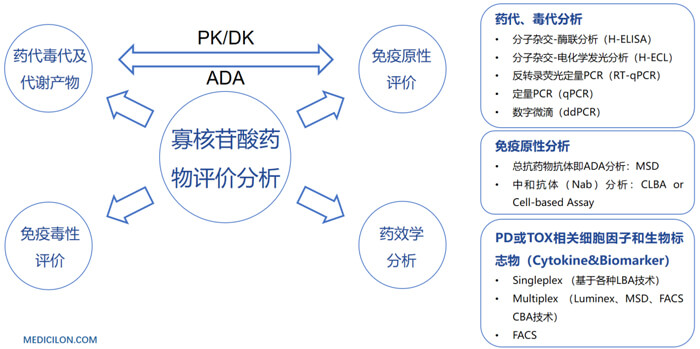
美迪西案例:Compound A –siRNA plasma quantification (20 µL plasma)
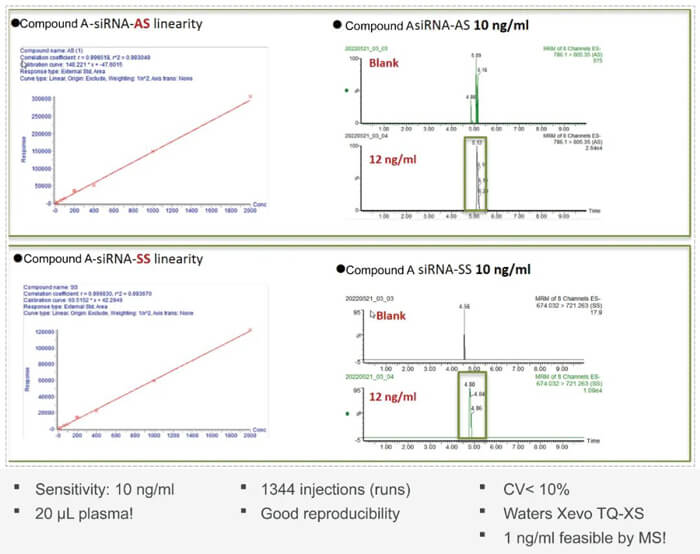
核酸药物药代动力学研究:
寡核苷酸用量规划设计环节中药配方代趋势学PK地方的挑战自我也是相应用量巨大的难点。未经许可的表达的寡核苷酸类用量成药力不佳;PK性能特点差;维持性好;易于被核酸酶降解塑料;地理分布性能特点差;和靶标地整合力不佳;海洋生物研究分析技术规划设计等级大等。使用化工工业淡化和递送软件系統行很好解決以下问題。渐渐技术工艺推动,区域瓶颈问题现如今能够很不错的很好解決土办法,这之中化工工业淡化行防止核酸类抗癫痫药材被核酸酶分解并提升半衰期,高效性安全防护的递送软件系統行使寡核苷酸类抗癫痫药材精准性的的靶向疗法组织,词有肝,并增长上皮细胞摄食率,使寡核苷酸类抗癫痫药材起着很不错的的冶疗功用。寡核苷酸抗癫痫药材从转录后级别变现的冶疗,能而对难易成药的特殊性蛋清靶点变现推动,还有机会攻取尚未抗癫痫药材的冶疗的疫情比如隐性基因性疫情和某些难治性疫情。
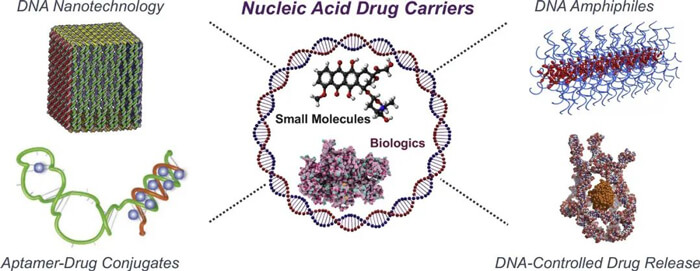
核酸药物递送壁垒[5]
美迪一些西药代和动结构力学技术团队要具备更加完善的寡核苷酸动物概述软件、肝部活体穿刺手术、身体肌肉活检和鞘内滴注软件采用PK和PK/PD调查。
美迪西食蟹猴B超引导下肝脏活体穿刺、肌肉活检和鞘内注射平台用于PK和PK/PD
DNA的治疗方法和核酸食用的食用的药物的的发展使用创建猴建模方法并开设相关联分析当上焦点。因DNA、型态学、生活生化学等显著特点与全社会程度相似性,使用非人灵长类(十分是食蟹猴)与全社会在演变联系上作为亲近,在建模方法建设方案、疫情管理机制分析并且 食用的食用的药物新产品研发方位优势可言明显。当今都已经创建了很多种疫情建模方法。在开展食蟹猴内脏器官发病症状模形发生变化的长远各式各样科学实验报告观查中,会因为受到了爬行動物发病症状模形与科学实验报告从客观先决条件的制约,在对他们发病症状模形的病理报告剖析和确诊时,科技研究技术人员大都依据盲穿或开刀手术或安乐死留取的形式能够得到肝企业,不但对爬行動物损伤大、在手术后护肤多样化,且易使得各种高副反应,不良于发病症状模形的长远观查。而美迪西食蟹猴做b超教育引流下肝胀活体腹穿术手术术网上渠道够较大限度地避放大静脉及胆囊,包括外伤小、腹穿术手术术控制安全管理非常简单、位置较准、手木后恢复正常非常好等其优势。做b超教育引流下肝胀活体腹穿术手术术网上渠道可实时的时间动态展示显示信息活检针进针留取的全程中,有很大程度的提高了了腹穿术手术术的出色率和研究毕竟的较准性,而且也推动了研究绿色福利金的建立健全,以及无数次应用软件于染色体缓解用药的药学前身体PK和PK/PD评价语的项目,并在一模一样自身绿色上不而且间点构建累计采集程序两份肝胀产品的样品。与此同时,食蟹猴腹肌活检游戏电商平台一样可实下面同一时间个人猎物上连继提取多个腹肌印刷品;相对神经机系统机系统医疗药材,产品局部位鞘内注射器游戏电商平台建立产品局部位医疗,都并能为人类基因保健法和核酸药材临床实践前PK和PK/PD评估提供数据强大支持系统。
美迪西DMPK部门管理做好食蟹猴胰腺腹穿活检代替PK/PD探析
寡核苷酸药物未来市场前景
寡核苷酸抗癫痫类药兼具特异形强、构思方便快捷的、科研激发期短、靶点多样化等长处,是某个生态学医药领域研究方案的要点。与此同时递送能力的成长与全新反复驱动核酸抗癫痫类药给药经由的前进。核酸抗癫痫类药递送游戏平台(偶联递送平台、纳米高技术粉末媒介等)的激发将驱动递送能力和多类给药经由(如:皮内填充、血管填充、雾化吸到吸到、瘤内填充等)的各自成长。的前景,时间推移寡核苷酸制剂的应运教育领域行业和工艺教育领域行业反复击破科学创新,工艺的更换将有助寡核苷酸制剂的的提升前景。市面 标准和市面 规模化将持续保持减少,寡核苷酸制剂的适于症位置广,有癌症、稀少病、宏病毒性患病、肾脏患病、先天之精管患病、宫颈炎症类患病、基础代谢类患病等。以至于,寡核苷酸制剂潜在的适于患者数量大,时间推移工艺的的提升前景和生产销售的旺盛期,寡核苷酸制剂市面 在的前景将有更一望无垠的的提升前景发展空间。
参考文献:
[1] Kazuki Takakura, et al. The Clinical Potential of Oligonucleotide Therapeutics against Pancreatic Cancer. Int J Mol Sci. 2019 Jul 6;20(13):3331. doi: 10.3390/ijms20133331.[3] Ageliki Laina, et al. RNA Therapeutics in Cardiovascular Precision Medicine. Front Physiol. 2018 Jul 25;9:953. doi: 10.3389/fphys.2018.00953. eCollection 2018.[4] Phuc Tran, et al. Delivery of Oligonucleotides: Efficiency with Lipid Conjugation and Clinical Outcome. Pharmaceutics. 2022 Feb 1;14(2):342. doi: 10.3390/pharmaceutics14020342.[2] Seong Jun Jo, et al. Clinical Pharmacokinetics of Approved RNA Therapeutics. Int J Mol Sci. 2023 Jan 1;24(1):746. doi: 10.3390/ijms24010746.[5] Xuyu Tan, etal. Nucleic acid-based drug delivery strategies. JControl Release. 2020 Jul 10;323:240-252.[6] David Bumcrot, et al. RNAi therapeutics: a potential new class of pharmaceutical drugs. Nat Chem Biol. 2006 Dec;2(12):711-9. doi: 10.1038/nchembio839.



















