



中国:
Email: marketing@czchengteng.com
业务范围管理咨询专线运输:400-780-8018 (仅限于贴心服务咨询了解。,许多情况说明请拨通川沙公司電話) 川沙茶企总部电话号码: +86 (21) 5859-1500海外:
+1(781)535-1428(U.S.) 0044 7790 816 954 (Europe)Email:marketing@medicilon.com



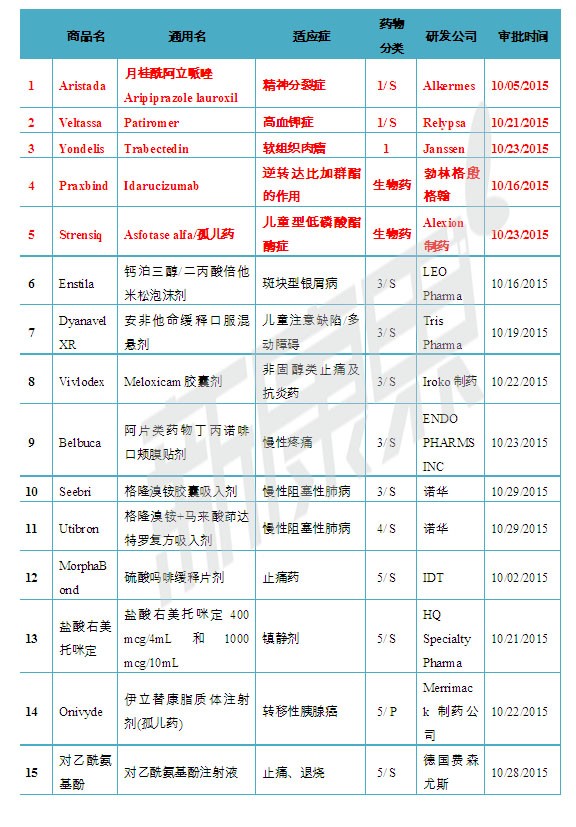
注:1)化学新药分类:1类新分子实体化合物;3类新剂型;4类新组合物; 5类药物新规格或新生产商;2)审批分类:P优先评审;S常规评审
2015年10月05日,美国FDA批准了Alkermes公司的新分子实体药物Aristada(Aripiprazole lauroxil,月桂酰阿立哌唑)上市。Aristada为缓释注射剂,用于精神分裂症患者的治疗。Aristada注射剂共有三种规格,分别含有月桂酰阿立哌唑441 mg、662 mg 和882 mg。精神分裂患者可每月注射441 mg、662 mg 和882 mg 的Aristada一次,或每6周注射882 mg 的Aristada一次。Aristada最常见的不良反应为静坐不能。Aristada带有黑框警告,提示患者和医生Aristada没有获得批准用于老年痴呆相关精神病的治疗,Aristada超适应征治疗老年痴呆相关精神病时或升高死亡风险。
2015年10月21日,美国FDA批准了Relypsa公司的新分子实体药物Veltassa(Patiromer)上市,用于高血钾症的治疗。Patiromer的作用机制是结合胃肠道中的钾从而降低钾的吸收,Patiromer为口服粉末状药物,共有8.4克, 16.8克和25.2克三种规格。Patiromer带有黑框警告,在临床使用时Patirome由于能与多种药物结合,从而降低了其他药物的吸收减弱药效。因此黑框警告中建议Patiromer和其他任何口服药物同服时,应间隔6小时以上。
2015年10月16日,美国FDA批准了勃林格殷格翰公司的新生物药物Praxbind(Idarucizumab)上市,用于接受抗凝药达比加群酯治疗的患者,在急诊手术、介入性操作、或者出现危及生命或无法控制的出血并发症,需要逆转达比加群酯的抗凝效应时使用。Idarucizumab是一种人源性单克隆抗体片段(Fab),临床使用时只与达比加群酯分子特异性结合,可中和其抗凝效应,不会干扰凝血级联。
2015年10月23日,美国FDA批准了Alexion制药公司的新生物药物Strensiq(Asfotase alfa)上市,用于儿童型低磷酸酯酶症的治疗。低磷酸酯酶症为罕见病,是由 ALPL 基因突变引起其编码的组织非特异性碱性磷酸酶活性降低引起的遗传性系统性疾病,以骨骼及牙齿硬组织发育不良以及血清碱性磷酸酶(ALP)活性偏低为特点。Strensiq为一种酶Asfotase alfa,可以通过替换缺陷的碱性磷酸酶,促进提高酶底物水平,提升机体骨矿物质化的能力,进而避免患者出现骨骼及其他器官严重异常和早夭。
美国FDA审批新药主要是根据药物化学类型和治疗潜能来进行分类的。新药按化学类型主要分为:1类新分子实体化合物(NME),创新性最强。指在美国从未作为药品批准或销售的活性成分,可以是单一成分,也可以是立体异构混合物中的一部分;2类新的衍生物。从已上市的活性成分(即所谓“专利”药)化学衍生而来,即已在美国上市的活性成分的酯、盐或其它非共价键衍生物,或者是去修饰基团的母体化合物未在美国批准上市的;3类新剂型。含有已上市活性成分的新剂型或新处方,其适应症可以与上市产品相同,也可以不同;4类新组合物。含有两种或两种以上已上市的活性成分的品种,上市产品中尚无这种组合;5类药物新规格或新生产商;6类新适应症。由同一家公司或其他公司在美国批准或上市的具有新用途的复制品;7类已上市但未经NDA批准的药品。适应症已与上市产品相同,也可不同;8类变为非处方药;9类(New indication submitted as distinct NDA - consolidated with original NDA after approval); 10类适应症不同的新的新药申请。

 相应新闻图片
相应新闻图片