



中国:
Email: marketing@czchengteng.com
销售咨询了解。旅游线:400-780-8018 (只能的服务谘询,另外的流程请加拨川沙茶企总部座机号) 川沙总公司热线: +86 (21) 5859-1500海外:
+1(781)535-1428(U.S.) 0044 7790 816 954 (Europe)Email:marketing@medicilon.com



在绝大数药物靶点中酶学靶点是一个大类。本文主要以酶催化的基本化学反应原理为起点,概述和阐述下酶催化反应的几个基本概念Km,Kcat和Ki,以及其测定方法,分析下一个灵敏的酶学筛选方法开发的几个关键步骤,概括论述下酶抑制剂的类型以及在实验检测过程中不同类型酶抑制剂的IC50和Ki之间的关联。
酶是生命体内化学反应的催化剂,能够在生理温度和常压下加快化学反应的速度,几乎所有的细胞活动进程都需要酶的参与以提高效率。特定酶活性或者表达量的增强或者缺少都有可能导致生命活动的异常,疾病的发生。在药物研发过程中酶是十分重要的靶点,也是十分有潜力和效果的靶点,如最近在中国上市的吉利德的慢性丙型肝炎新药索华迪(索磷布韦),其效果和价格一样让人印象深刻,一个疗程6万人民币左右,对于基因1,2,3,6型HCV具有抗病毒活性,治愈率高达92%-100%,其作用的靶点是NS5B RNA聚合酶;又如晚期大肠癌的一线用药是伊立替康,其代谢活性成分SN-38是DNA拓扑异构酶Ⅰ抑制剂,其与拓扑异构酶Ⅰ及DNA形成的复合物能引起DNA单链断裂,阻止DNA复制及抑制RNA合成,为细胞周期S期特异性。首款获得FDA批准的双药HIV疗法新药Juluca,其两个活性成分,Dolutegravir是HIV-1整合酶链转移抑制剂(integrase strand transfer inhibitor,INSTI);Rilpivirine是一款非核苷逆转录酶抑制剂(non-nucleoside reverse transcriptase inhibitor,NNRTI)。酶作为一个很有潜力的靶点,如何建立一个简单高通量的酶学抑制物的筛选方法是这篇文章笔者主要讨论的问题。我们可以重温一下酶学基本的反应原理开始酶催化反应原理
绝大多数酶学反应都可以用下图简单的模型进行描述:
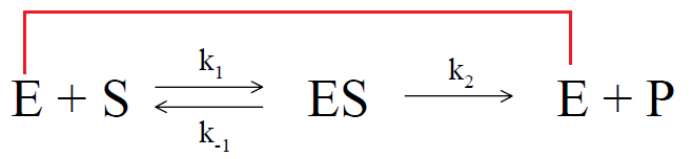
E代表酶,S代表底物,P代表催化产物。ES代表在催化反应开始前形成的中间态产物酶-底物复合物,E和S形成ES复合物的反应是可逆反应的过程,k1是E和S形成ES复合物的结合速率常数,相当于配体受体结合时的Kon或者Ka, k-1是ES解离形成E和S的解离速率常数,相当于配体受体结合时的Koff或者Kd(关于以上概念可参考笔者前期的文章--生物功能学筛选评价技术之亲和力评价篇);ES解离形成E和P的过程在反应初期一般认为是不可逆的过程,反应产物E会被反应体系中的过量的S捕捉,k2是ES形成E和P的速率常数,也被称之为Kcat,相当于配体受体结合时的Kon或者Ka酶催化效率:
一个酶相对于其底物的催化效率主要由两个方面决定Kcat/Km, Km值(米氏常数)越小, Kcat值越大,催化效率越高。Km值的化学本质是E和S可逆反应过程中的解离平衡常数KD,反映的是E和S亲和力的强弱,Km值越小亲和力越强,效率越高。Kcat值是ES解离形成E和P的速率常数。Km值和Kcat值测定
米氏方程描述了在稳态反应条件下酶催化反应中初始反应速度V和底物浓度 [S]的相关关系:
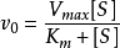
当V等于1/2的 Vmax时,底物浓度 [S]为Km值。
在实际的检测过程主要包括以下几个步骤:
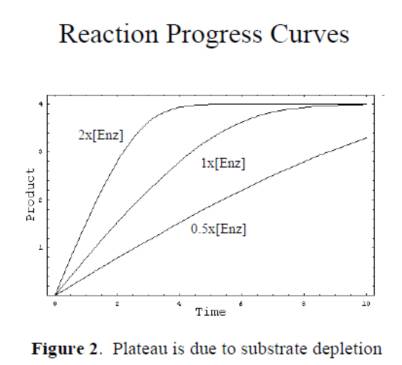
1. 少量固定浓度的酶(nM或者pM级别),梯度浓度稀释的底物(底物浓度相对于酶浓度由远远过量,mM到μM)进行分组,酶催化反应;
2. 每个分组对酶催化反应的产物进行动力学检测(酶标仪进行荧光,吸光度检测或者HPLC检测),选取各分组信号时间的线性反应区域进行V计算;
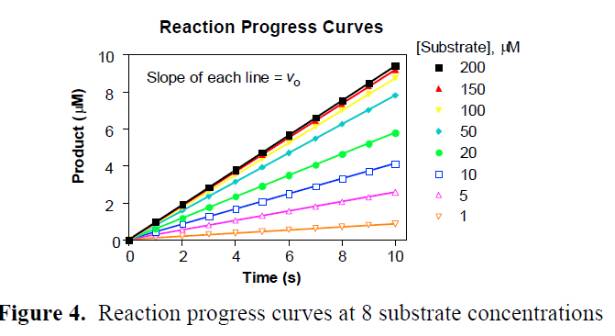
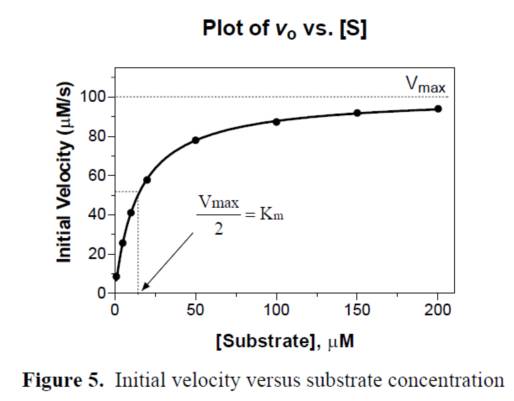
3. 选取梯度浓度稀释的底物动力学检测的线性区域的斜率作为初始反应速度V进行数据米氏方程拟合,拟合图形的平台期为Vmax, 1/2的Vmax时V对应的底物浓度值是Km值。处理结果示意图如下:
4. 当酶催化反应达到最大速度时,S远远大于E,所以所有的E均被S捕获,E和S的逆反应速度可忽略不计,[ES]=[E]
Vmax=[ES]*Kcat=[E] *Kcat,所以Kcat= Vmax/[E]
以上是Km和Kcat的测定和计算过程,值得注意的是在实际的实验过程中需要注意以下几点:
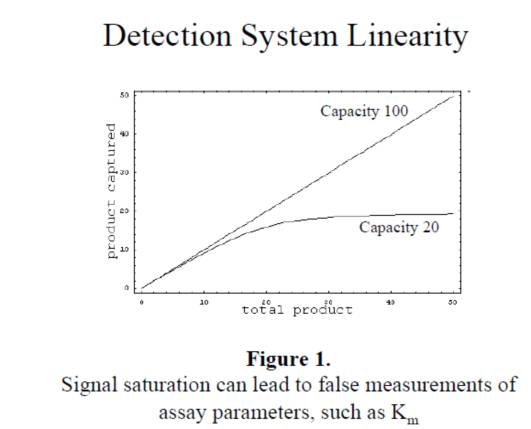
2. 必须确认仪器的检测线性,当酶催化反应,产物的量过多时,超过仪器检测的线性区域时,检测的产物的量不准,影响到后续参数的计算,如下图:
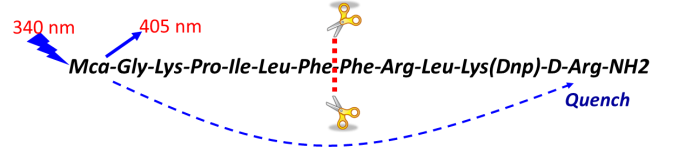
酶学筛选方法的几个核心参数包括酶,反应环境,底物和抑制物。一般来讲反应环境需要查阅文献进行调研,确定PH值,离子强度,洗涤剂等对酶活的影响,底物可以根据酶催化原理选择天然底物,也可以选择合成底物(底物的选择和后续配套的检测方法紧密相关)。一个酶学方法的开发可能涉及到以下一些因素:
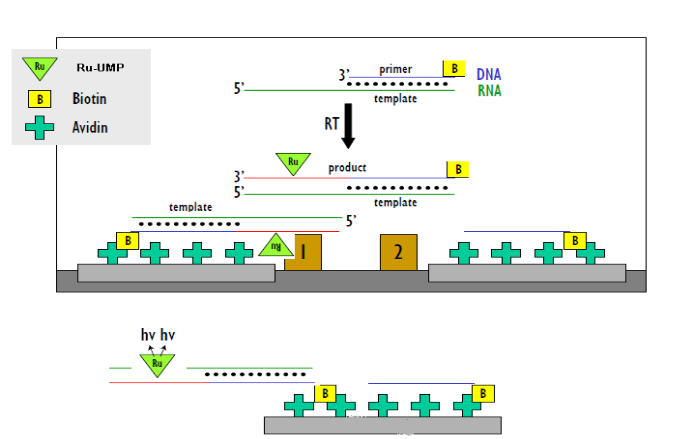
对于靶点酶的抑制剂,主要可以归纳为三类(competitive竞争性, noncompetitive非竞争性, uncompetitive不竞争性)
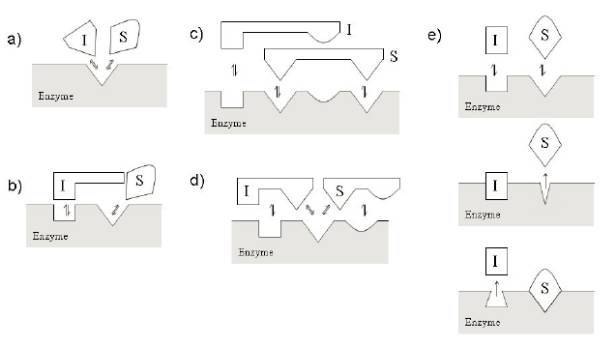
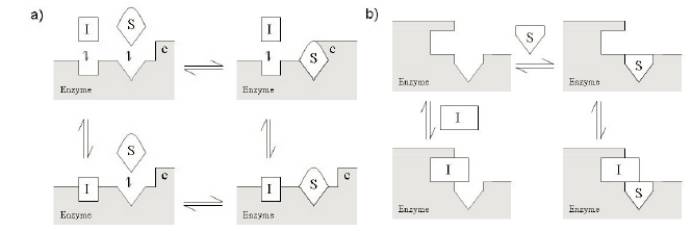
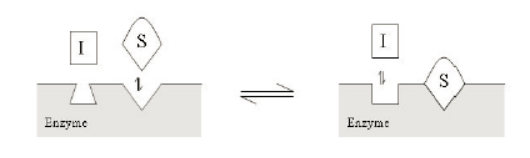

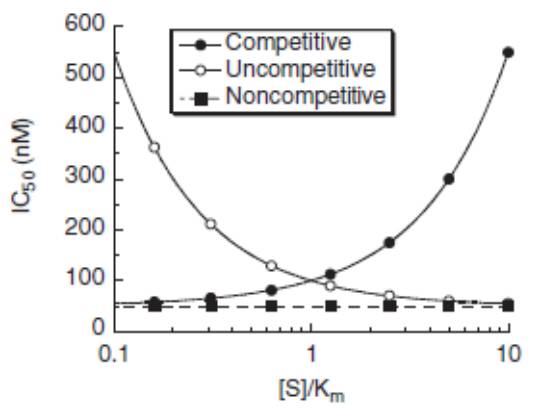
绝大多数生命活动的调控均是有酶的参与,对酶的选择性抑制可以调控细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程,如JAK抑制剂,IDO抑制剂等在临床研究或者市场上证明了其价值或者潜在的价值。了解酶学反应的化学原理,搭建合适的酶学筛选模型;表征酶抑制剂的不同抑制机理,也有助于细微区分不同抑制机理药物可能起到的差异性的临床获益。
利用酶催化反应进行体外的功能学检测也是常用的工具,如ELISA中HRP酶的催化显色,细胞活性检测时琥珀酸脱氢酶催化的CCK8检测,报告基因检测过程中luciferase酶催化的化学发光等,了解其化学原理和动力学反应进程有助于功能学方法学开发,优化检测方法的条件。
酶催化反应是理解体外生物功能学评价体系承上启下的一环,此反应过程描述了是从Binding(affinity)转换到function(potency)的过程,且在理想条件下此过程是线性传递的,即产物生成量是ES的量和Kcat的乘积,Vp=[ES]*Kcat。与之相对的,蛋白相互作用过程中,只有Binding(affinity),大部分受体介导的细胞学效应既有Binding(affinity),也有function(potency),但是由Binding(affinity)到function(potency)之间的传递往往是非线性的,每种细胞由于其细胞内环境蛋白的表达差异性会导致由胞外结合引起的刺激非均一放大形成差异性效用。下一篇笔者将会对更为复杂的细胞学相关测定方法进行讨论。
借鉴知料
《Guidance for Assay Development & HTS》
SECTION V: ENZYMATIC ASSAYS
SECTION XII: MECHANISM OF ACTION ASSAYSFOR ENZYMES
 相关行业新闻
相关行业新闻